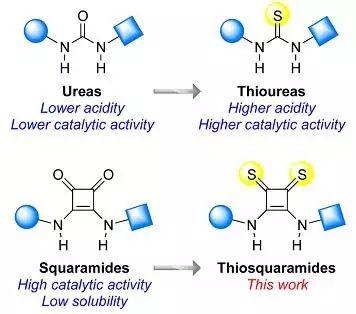
图1. 氢键骨架的发展。图片来源:JACS
作者首先介绍了该催化剂的合成方法,商品化的方酰胺酯与胺类化合物发生取代反应得到中间体2,中间体2在Lawesson试剂的参与下生产硫代中间体3,中间体3再与手性胺发生取代反应得到最终的催化剂A-E(图2)。与O-方酰胺相比,S-方酰胺的溶解度更好。如催化剂F在室温条件下于甲苯中只有小于0.1 mg/mL的溶解度,而E却有大于3 mg/mL的溶解度。作者通过理论计算、NMR表征等方法发现S-方酰胺比相应的O-方酰胺的酸性高4−5个数量级。
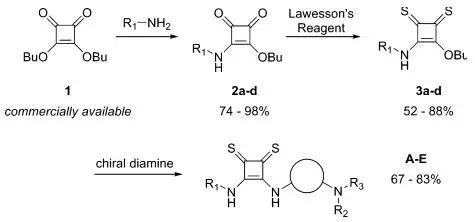
图2. 催化剂合成。图片来源:JACS
为了对硫代方酰胺的结构有更加深入的了解,作者培养了催化剂A的单晶(图3),经观察A有两个旋转异构体,其中一个就是如下图所示的二甲胺基指向前方的结构。两个异构体N−H键的氢原子距离分别为2.43 Å和2.64 Å,而硫脲和O-方酰胺的距离分别为2.1 Å和2.7 Å。Hartree-Fock计算相同的结构得到的两个氢之间的距离是2.60 Å,得出的结论是较小的两个氢之间的距离是由于硫原子的相互作用,而不是晶体中其它作用力导致的(图3)。
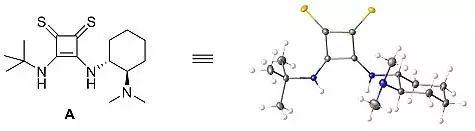
图3. 晶体结构。图片来源:JACS
作者随后选择硝基烯烃4a和巴比妥酸5a作为模板底物考察一系列的反应条件。首先是固定甲苯作为溶剂,考察了催化剂A-F,权衡转化率和对映选择性,催化剂E给出的催化结果,以>98%的转化率和97%的对映选择性得到产物6a。作者随后对溶剂和催化剂的用量进行了筛选,的反应条件是:E作为催化剂,甲苯作为溶剂于室温条件下反应(图4)。
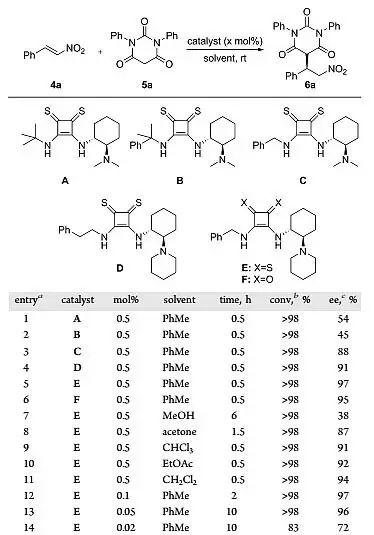
图4. 条件筛选。图片来源:JACS
在条件下,作者对底物的普适性进行了研究,考察了R1和R2取代基对反应的影响(图5)。从结果可以看出,不管R1和R2是(杂)芳基取代基还是烷基取代基,不管芳香环取代基在邻位、间位,还是对位,不管取代基是给电子基团还是吸电子基团,都能以良好的产率(88-99%)、优秀的对映选择性(72-98.5%)得到目标产物6a-6p。反应对脂肪族硝基烯烃和大位阻的芳基硝基烯烃底物而言,反应时间要更久。产物的构型通过6f的氯代产物7f的晶体结构得以确定(图6)。
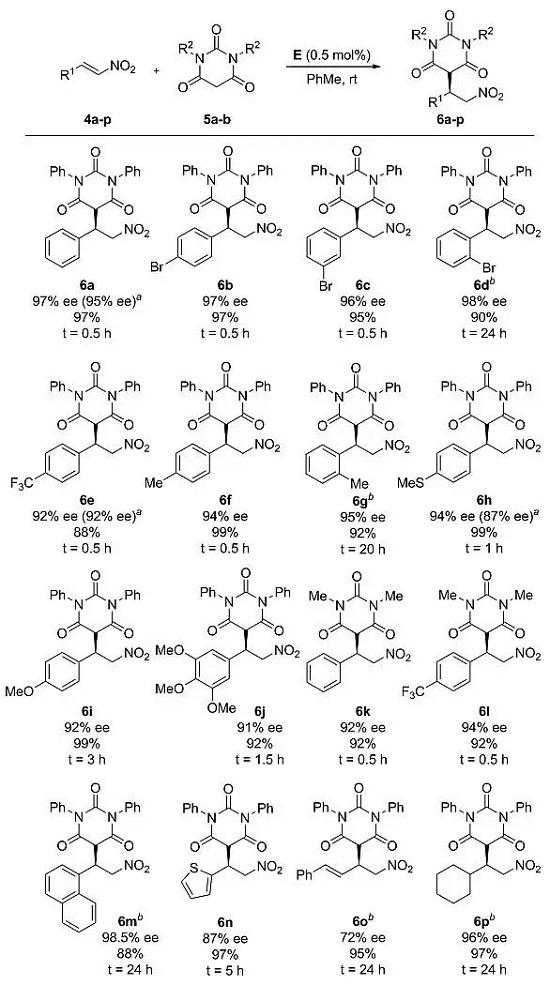
图5. 底物拓展。图片来源:JACS
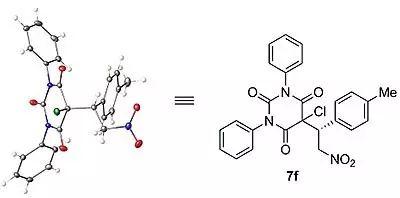
图6. 晶体结构。图片来源:JACS
总结
本文报道了Rawal教授团队首例硫代方酰胺的合成和巴比妥酸对硝基烯烃的加成反应,高效合成了一系列手性巴比妥酸类衍生物。与O-方酰胺相比,S-方酰胺不管是活性还是溶解度都更具有优势。
原文:
Development of Chiral, Bifunctional Thiosquaramides: Enantioselective Michael Additions of Barbituric Acids to Nitroalkenes
J. Am. Chem. Soc., 2017, 139, 5297-5300, DOI: 10.1021/jacs.7b01115
