背景[1-6]
哺乳动物细胞表达系统能够为重组人源蛋白提供最接近于天然状态的翻译后修饰,在蛋白表达过程中会形成接近天然蛋白的蛋白质折叠和聚合,具备活性蛋白所必须的空间结构和修饰。
由哺乳动物细胞翻译后再加工修饰产生的外源蛋白质,在活性方面远胜于原核表达系统及酵母、昆虫细胞等真核表达系统,更接近于天然蛋白质。这一特性使得哺乳动物细胞表达系统在重组蛋白药物,特别是治疗性重组单抗药物的研发和生产中有最为广泛的应用。
哺乳动物细胞表达系统的优势在于能够指导蛋白质的正确折叠,提供复杂的N型糖基化和准确的O型糖基化等多种翻译后加工功能,因而表达产物在分子结构、理化特性和生物学功能方面最接近于天然的高等生物蛋白质分子。从最开始以裸露DNA直接转染哺乳动物细胞至今的30余年间,哺乳动物细胞表达系统不仅已成为多种基因工程药物的生产平台,在新基因的发现、蛋白质的结构和功能研究中亦起了极为重要的作用。
根据进入宿主细胞的方式,可将表达载体分为病毒载体与质粒载体。病毒载体是以病毒颗粒的方式,通过病毒包膜蛋白与宿主细胞膜的相互作用使外源基因进入到细胞内。常用的病毒载体有腺病毒、腺相关病毒、逆转录病毒等。
哺乳动物细胞表达载体的必要元件包括:一个高活性的启动子、转录终止序列和一个有效的mRNA翻译信号。可视实验需要加入标志基因、复制起始点序列、内部核糖体进入位点等。
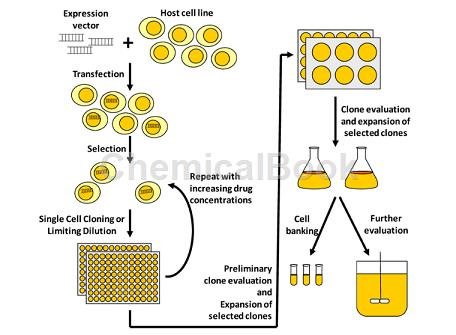
常用的几种用于表达重组蛋白的细胞株有CHO细胞、骨髓瘤细胞株和 COS细胞、293细胞等。根据目的蛋白表达的时空差异,可将表达系统分为瞬时、稳定和诱导表达系统。瞬时表达系统是指宿主细胞在导入表达载体后不经选择培养,载体 DNA 随细胞分裂而逐渐丢失,目的蛋白的表达时限短暂;瞬时表达系统的优点是简捷,实验周期短。
大规模的瞬时表达技术是近年来的一个研究热点,已有报道能放大到 100L反应器中生产重组蛋白,产量(分泌型蛋白)可达 1-10mg/L。不过该方法技术条件要求高,如质粒的纯度、转染的效率等。哺乳动物细胞表达系统中,重组蛋白的表达水平与许多 因素相关,如转录和翻译调控元件、RNA剪接过程、mRNA稳 定性、基因在染色体上的整合位点、重组蛋白对细胞的毒性作 用以及宿主细胞的遗传特性等.
应用[7][8]
1.部分蛋白在哺乳动物细胞中的表达已从实验室研究迈向生产或中试生产阶段。
2.已有许多重要的蛋白及糖蛋白利用哺乳动物细胞系统表达和大量制备、生产。如人组织型血纤蛋白酶原激活因子、凝血因子Ⅷ、干扰素、乙肝表面抗原、红血球生成激素、人生长激素、人抗凝血素Ⅲ,集落刺激因子等。有些产品已投入临床应用或试用。
3.虽然经过多年努力,哺乳动物细胞表达系统的表达水平有大幅度增高,但从整个水平上看仍偏低,一般处在杂交瘤细胞单克隆抗体蛋白产率的下限,即1-30μg/l08细胞/24小时。有人认为其限速步骤可嚣是在工程细胞中(对于重组蛋白来讲,常是异源的),重组蛋白的分泌效率较低。
参考文献
[1]Anti‐cell death engineering of CHO cells:Co‐overexpression of Bcl‐2 for apoptosis inhibition,Beclin‐1 for autophagy induction[J].Jae Seong Lee,Tae Kwang Ha,Jin Hyoung Park,Gyun Min Lee.Biotechnol.Bioeng..2013(8)
[2]Rapid construction of transgene-amplified CHO cell lines by cell cycle checkpoint engineering[J].Kyoung Ho Lee,Masayoshi Onitsuka,Kohsuke Honda,Hisao Ohtake,Takeshi Omasa.Applied Microbiology and Biotechnology.2013(13)
[3]Control of IgG LC:HC ratio in stably transfected CHO cells and study of the impact on expression,aggregation,glycosylation and conformational stability[J].Steven C.L.Ho,Esther Y.C.Koh,Miranda van Beers,Monika Mueller,Corrine Wan,Gavin Teo,Zhiwei Song,Yen Wah Tong,Muriel Bardor,Yuansheng Yang.Journal of Biotechnology.2013(3-4)
[4]Rational development of a serum-free medium and fed-batch process for a GS-CHO cell line expressing recombinant antibody[J].Huifeng Zhang,Haibin Wang,Mei Liu,Tao Zhang,Ji Zhang,Xiangjing Wang,Wensheng Xiang.Cytotechnology.2013(3)
[5]Enhancement of recombinant human EPO production and glycosylation in serum-free suspension culture of CHO cells through expression and supplementation of 30Kc19[J].Ju Hyun Park,Zesong Wang,Hee-Jin Jeong,Hee Ho Park,Byung-Gee Kim,Wen-Song Tan,Shin Sik Choi,Tai Hyun Park.Applied Microbiology and Biotechnology.2012(3)
[6]A universal nanoparticle cell secretion capture assay[J].Wendy Fitzgerald,Jean‐Charles Grivel.Cytometry.2012(2)
[7]Simple scale-up of recombinant antibody production using an UCOE containing vector[J].Sabrina Boscolo,Francesca Mion,Marta Licciulli,Paolo Macor,Luca De Maso,Martina Brce,Michael N.Antoniou,Roberto Marzari,Claudio Santoro,Daniele Sblattero.New BIOTECHNOLOGY.2011(4)
[8]The isolation of CHO cells with a site conferring a high and reproducible transgene amplification rate[J].Jonathan J.Cacciatore,Edward F.Leonard,Lawrence A.Chasin.Journal of Biotechnology.2012(2)
