背景[1-4][6]
非靶向代谢组学非是在有限的相关研究和背景知识的基础上,对整个代谢组进行系统、全面的分析,获取大量代谢物的数据,并对其进行处理,从而找出差异代谢物的一种研究方法。目前,非靶向代谢组学分析在生物标志物的发现、疾病的诊断和机制研究等方面应用广泛,并且为解决一些疾病机制研究的瓶颈问题提供了新的思路和方向。
1. 基本流程
1.1样本的采集、前处理与分析
样本的采集是代谢组学研究的初始步骤也是最重要的步骤之一,常用于代谢组学分析的样本包括血浆、尿液、各种组织及细胞、细胞器等。代谢组学研究要求严格的实验设计,足够大的样本量可有效减少因生物样本个体差异造成对分析结果的影响,从而得到有统计学意义的数据。
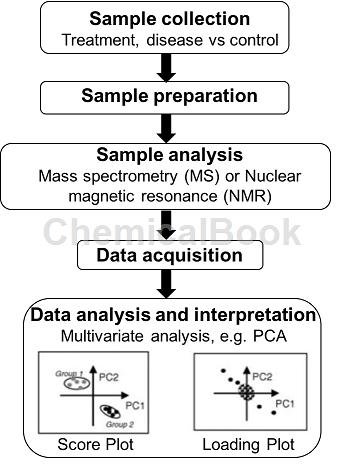
样本前处理的目的是从成分复杂的生物样本中提取出被分析物,减少其他成分对测定结果的干扰,也是影响代谢组学研究结果的关键因素。常用的样本前处理方法包括固相萃取、液液萃取、超临界流体萃取、加速溶剂萃取、蛋白质沉淀、差速离心等。
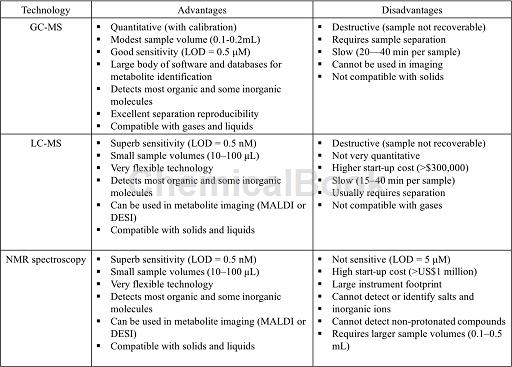
使用单一的分析技术往往不能满足代谢组学的分析要求。因此,代谢组学常需要多种分析手段的结合。近年来,核磁共振(NMR)、气相色谱-质谱联用(GC-MS)、液相色谱-质谱联用(LC-MS)以及毛细管电泳-质谱联用(CE-MS)已被广泛应用于代谢组学的研究中。分析手段的进步与代谢组学的发展密不可分,是代谢组学学科发展的主要推动力之一。
1.2数据处理
代谢组学数据需要通过分析和比较找出差异代谢物。常用的数据分析方法包括主成分分析(principal component analysis,PCA)、偏最小二乘判别分析(partial least squares projection to latentstructuresdiscriminant analysis,PLS-DA)、正交偏最小二乘判别分析(orthogonal projections to latent structuresdiscriminantanalysis,OPLS-DA) 等。
应根据实际情况选择适宜的分析手段,从而得到可信的分析结果,同时还需结合t 检验和变量权重重要性排序(variableimportance in projection,VIP)值筛选差异性代谢物,一般认为同时满足P 小于0.05 和VIP 值大于1.0 的变量为有差异的代谢物。
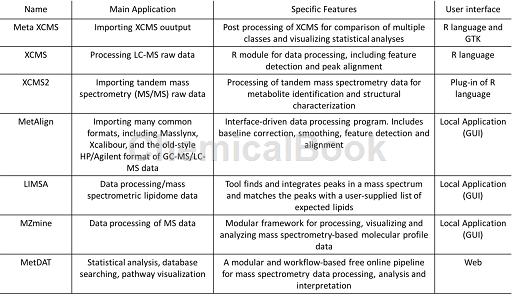
随着代谢组学分析技术日渐成熟,各种代谢组学数据库和处理软件也越来越多根据不同的分析方法,可以在不同的数据库里对化合物谱图进行归属,从而得出差异代谢物的化学结构和名称。在药物靶点的发现过程中,往往需要进行进一步的机制研究,此时可利用KEGG、Metacyc 等数据库进行代谢通路分析,以便掌握相关的代谢通路并开展后续研究。
应用[6][7][8]
1.发现心血管疾病治疗的潜在靶点
氧化三甲胺(trimethylamine N-oxide,TMAO)的含量升高会引起脂质的异常累积,从而增加罹患心血管疾病的风险。Wang 等在对心血管疾病的研究中,采用非靶向代谢组学分析显示心血管疾病患者血浆内TMAO 的含量明显升高。从食物中摄取的胆碱类物质能在肠道菌群中胆碱-三甲胺(TMA)裂解酶的作用下生成TMA,后者进一步在肝脏经黄素单加氧酶3(flavinmonooxygenase3,FMO3)催化代谢生成TMAO。
进一步研究表明,FMO3 过表达转基因小鼠在相同的高胆碱饮食条件下,其血浆内TMAO的含量明显高于野生型小鼠。通过反义寡核氨酸技术沉默FMO3 表达的小鼠,其血浆中TMAO的含量显著低于对照组,表明FMO3 能通过调节血浆内TMAO 含量进一步影响动脉粥样硬化及其他心血管疾病的发病过程。上述源于代谢组学的研究表明,FMO3 可能成为治疗心血管疾病的潜在靶点。
2.发现肿瘤治疗的潜在靶点
Gao等利用毛细管电泳-质谱技术,对神经胶质瘤样本进行非靶向代谢组学分析,发现瘤组织中的亚牛磺酸含量显著高于癌旁对照组织中的亚牛磺酸,并且与胶质瘤分级(恶性程度)呈正相关。经过分子对接计算机模拟,Gao等发现亚牛磺酸能够竞争性抑制脯氨酸羟化酶2(prolylhydroxylasedomain-2,PHD2)的催化活性,影响羟基化缺氧诱导因子-1α(hypoxia-induciblefactor 1α,HIF-1α)的降解,促进其入核,从而启动许多与肿瘤相关基因的表达。
因此,细胞内亚牛磺酸的含量升高可促进肿瘤的发生发展。研究发现,细胞内亚牛磺酸以胱氨酸为前体物质合成,而胱氨酸需通过胱氨酸/谷氨酸反向转运体(XC-glutamate-cystineantiporter)的转运才能进入细胞,抑制该转运体可以阻断亚牛磺酸的生物合成,从而抑制肿瘤细胞的增殖和侵袭。因此,胱氨酸/谷氨酸反向转运体可能可以作为治疗神经胶质瘤的潜在靶点。
在一项急性髓细胞白血病的研究中,Bhanot等利用多种酪氨酸激酶抑制剂对白血病癌细胞株进行处理,对不同处理的细胞株进行非靶向代谢组学分析,发现癌变髓细胞内源性代谢组显著改变,一系列内源性代谢物,如与糖酵解、三羧酸循环、糖原合成等能量代谢相关的代谢物显著改变,其中糖原合成前体UDP-D-葡萄糖水平在癌变细胞株内异常升高。
进一步机制研究表明,肿瘤细胞代谢重编程依赖糖原合成途径,进行能量储备。糖原合成酶1(glycogensynthase 1,GYS1)活性异常升高的患者往往预后较差。抑制GYS1不仅降低糖酵解通量,而且导致肿瘤细胞生长受到抑制。新的靶向治疗策略可以靶向抑制GYS1,从而影响肿瘤细胞能量代谢和生长,故GYS1有望成为新的治疗靶点。
参考文献
[1]Daviss,Bennett(April 2005)."Growing pains for metabolomics".The Scientist.19(8):25–28.
[2]Jordan,KateW.;Nordenstam,Johan;Lauwers,Gregory Y.;Rothenberger,DavidA.;Alavi,Karim;Garwood,Michael;Cheng,Leo L.(2009)."Metabolomic Characterization of Human Rectal Adenocarcinoma with Intact Tissue Magnetic Resonance Spectroscopy".Diseases of the Colon&Rectum.52(3):520–525.
[3]Oliver SG,Winson MK,Kell DB,Baganz F(September 1998)."Systematic functional analysis of the yeast genome".Trends in Biotechnology.16(9):373–8.
[4]Griffin JL,Vidal-Puig A(June 2008)."Current challenges in metabolomics for diabetes research:a vital functional genomic tool or just a ploy for gaining funding?".Physiol.Genomics.34(1):1–5.
[5]Ogbaga,Chukwuma C.;Stepien,Piotr;Dyson,Beth C.;Rattray,Nicholas J.W.;Ellis,David I.;Goodacre,Royston;Johnson,Giles N.(6 May 2016)."Biochemical Analyses of Sorghum Varieties Reveal Differential Responses to Drought".PLOS ONE.11(5):e0154423.Bibcode:2016PLoSO..1154423O.
[6]"Gas Chromatography Mass Spectrometry(GC-MS)Information|Thermo Fisher Scientific-US".www.thermofisher.com.Retrieved 2018-09-26.
[7]Katajamaa M,Miettinen J,Oresic M(March 2006)."MZmine:toolbox for processing and visualization of mass spectrometry based molecular profile data".Bioinformatics.22(5):634–36.
[8]Lommen A(April 2009)."MetAlign:interface-driven,versatile metabolomics tool for hyphenated full-scan mass spectrometry data processing".Anal Chem.81(8):3079–86.
