背景[1-6]
EHA101 Electro感受态细胞使用EHA101菌株为C58型背景制作,核基因中含有筛选标签——利福平抗性基因rif,为了便于转化操作,此菌株携带一无自身转运功能的胭脂碱型Ti质粒pEHA101(pTiBo542DT-DNA),此质粒含有vir基因(vir基因是T-DNA插入植物基因组必需的元件,pEHA101(pTiBo542DT-DNA)质粒自身的T-DNA转移功能被破坏,但可以帮助转入的双元载体T-DNA顺利转移)。
pEHA101(pTiBo542DT-DNA)型Ti质粒含有筛选标签:strep、kan,赋予EHA101菌株链霉素抗性和卡那霉素抗性,适用于玉米、水稻、烟草等植物的转基因操作,经pK7WGF2质粒检测转化效率可达104cfu/μgDNA。EHA101电转感受态特别适用于大质粒的转化:经pK7WGF2质粒(壮观霉素抗性,size:11876 bp)检测转化效率>105 cfu/μg DNA;经pK7WGF2-ZH质粒(size:40 kd)检测转化效率可达5×103 cfu/μg DNA。
制备方法
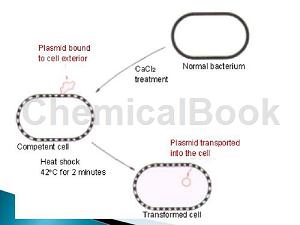
1.0.1 cm电击杯和杯盖从储存液中拿出倒置于干净的吸水纸上5分钟,待其沥干水分,正置5分钟,使乙醇充分挥发,待乙醇挥发干净立即插入冰中,压实冰面,电极杯顶离冰面0.5 cm以方便盖上杯盖,冰中静置5分钟充分降温。
2.取-80℃保存的农杆菌感受态插入冰中5分钟,待其融化,加入1-5μg质粒DNA(质粒体积不大于6ul,用试剂盒抽提,双蒸水溶解),用手拨打管底混匀,立即插入冰中,用200μl枪头将感受态-质粒混合物快速移到电击杯中,盖上杯盖,空管保留待用。
3.启动电转仪,设置参数:C=25μF,PC=200 ohm,V=2400 V(此参数为Biorad推荐,使用者也可按所用电转仪推荐的protocol操作),将电击杯快速放入电转槽中,电击完成快速插入冰中,加入700μl无抗生素的LB并转移到感受态空管中,28℃振荡培养2~3小时。
4.6000 rpm离心一分钟收菌,留取100μl左右上清轻轻吹打重悬菌块涂布于含相应抗生素的LB或YEB平板上,倒置放于28℃培养箱培养2-3天
(当平板只含有转化所用双元载体抗生素时,28℃培养48小时即可;平板中同时加入双元载体抗生素,20μg/ml rif时,需28℃培养60小时;如果使用的平板含有50μg/ml rif则需要28℃培养72-90小时)。
注意事项
1.加入质粒时体积不应大于感受态体积的1/10;质粒不纯或存在乙醇等有机物污染,转化效率急剧下降;质粒增大一倍,转化效率下降一个数量级。
2.混入质粒时应轻柔操作。转化高浓度的质粒可相应减少最终用于涂板的菌量。
3.平板上阳性克隆密度过大时,由于营养不足,阳性克隆生长变慢,菌落变小,为了获得大的菌落,应减少质粒用量。
4.利福平浓度不应高于25μg/ml,过高的利福平浓度不利于农杆菌生长,会降低其生长速度和转化效率。
5.培养基中加入利福平的目的是防止杂菌生长、筛选农杆菌;根据所用菌株抗性加入Ti质粒筛选抗生素可防止Ti质粒丢失,但Ti质粒筛选抗生素不利于农杆菌的转基因操作,所以一般培养农杆菌时不考虑这些抗生素,Ti质粒丢失的概率极低(可以忽略)。
应用[7][8]
EHA101 Electro感受态细胞可用于植物基因克隆转化研究:
向棉花基因组中导入外源基因的方法有多种,其中农杆菌介导法是最为有效的方法之一,转入的外源基因多以单拷贝插入,便于育种工作的利用。目前用该方法进行棉花遗传转化通常选用下胚轴或子叶为受体材料,转化周期长,一般需要9~12个月才能获得转基因植株;再生过程中,只有极少数被转化的细胞能够诱导出胚性愈伤组织进而再生为转化植株,转化效率低。
本实验利用棉花胚性愈伤组织作为农杆菌转化的受体材料,绕过了抗性愈伤诱导胚性愈伤的过程,转化周期缩短了3~4个月;所获得的抗性胚性愈伤组织能够直接再生成苗,克服了下胚轴做受体时容易获得抗性愈伤、但不易获得转基因植株的缺点,提高了棉花遗传转化的工作效率;并把一个双价阳离子抗菌肽基因成功地导入棉花。
主要结果如下:建立了农杆菌转化棉花胚性愈伤组织的遗传转化体系利用gus-intron基因瞬时表达技术,研究了影响农杆菌介导棉花胚性愈伤组织遗传转化的因素,进而建立了农杆菌介导棉花胚性愈伤组织的遗传转化体系。
研究结果表明:重悬液和共培养培养基中加100μmol/L乙酰丁香酮(Acetosyringone,AS)可以明显提高3个菌株(LBA4404、EHA101和EHA105)的侵染能力,其中LBA4404提高最为明显,为原来的13.6倍;在3种农杆菌菌株中,EHA101侵染能力最强;棉花胚性愈伤组织与菌株EHA101共培养4d可以获得满意的转化瞬时表达效果;在不同发育时期的体胶中,子叶胚对农杆菌的侵染比较敏感;实验中采用的3个受体基因型的胚性愈伤组织对农本卜人侵染的敏感性差异不大。
参考文献
[1]High-frequency stable transformation of cotton(Gossypium hirsutum L.)by particle bombardment of embryogenic cell suspension cultures[J].K.Rajasekaran,R.L.Hudspeth,J.W.Cary,D.M.Anderson,T.E.Cleveland.Plant Cell Reports.2000(6)
[2]Expression of soybean b-1,3-endoglucanase cDNA and effect on disease tolerance in kiwifruit plants[J].Y.Nakamura,H.Sawada,S.Kobayashi,I.Nakajima,M.Yoshikawa.Plant Cell Reports.1999(7-8)
[3]Transformation of a Texas cotton cultivar by using Agrobacterium and the shoot apex[J].C.Zapata,S.H.Park,K.M.El-Zik,R.H.Smith.TAG Theoretical and Applied Genetics.1999(2)
[4]Transgenic cotton resistant to herbicide bialaphos[J].GREG KELLER,LORI SPATOLA,DENNIS McCABE,BRIAN MARTINELL,WILLIAM SWAIN,MALIYAKAL E.JOHN.Transgenic Research.1997(6)
[5]Herbicide-resistant Acala and Coker cottons transformed with a native gene encoding mutant forms of acetohydroxyacid synthase[J].Kanniah Rajasekaran,John W.Grula,Richard L.Hudspeth,Shoshana Pofelis,David M.Anderson.Molecular Breeding.1996(4)
[6]A procedure for biolistic transformation and regeneration of transgenic cotton from meristematic tissue[J].Caryl A.Chlan,Junmin Lin,Jeffery W.Cary,Thomas E.Cleveland.Plant Molecular Biology Reporter.1995(1)
[7]Protease inhibitors of Manduca sexta expressed in transgenic cotton[J].John C.Thomas,Deanna G.Adams,Veronique D.Keppenne,Catherine C.Wasmann,Judith K.Brown,Michael R.Kanost,Hans J.Bohnert.Plant Cell Reports.1995(12)
[8]鲁秀敏.农杆菌介导棉花胚性愈伤转化体系的建立及转AFP-SPCEMA基因棉花的获得[D].西南农业大学,2003.
