背景[1-6]
昆虫基因组DNA提取试剂盒采用独特的裂解液能够有效除去多糖多酚等,能够从昆虫、软体动物、节肢动物、蛔虫等样品中提取DNA,保存在在醇类的样品也适用于本试剂盒的提取。一次操作可以处理小于50mg组织,样品经裂解液消化,氯仿分离除去大部分的多糖多酚,再经分离柱进一步纯化,便可得到高纯度的DNA。所得的DNA可以用于PCR,Southern杂交,酶切消化等实验。昆虫基因组DNA提取试剂盒专门为从昆虫等低等非脊索动物,包括某些植物组织中提取基因组DNA而设计。该方法结合了CTAB裂解法和硅胶柱纯化方式,能有效地去除各种色素,甲壳素,多糖等杂质。
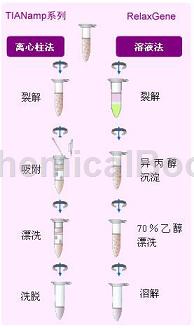
纯化的DNA可直接用于PCR,Southern杂交,酶切等后续实验。昆虫组织(细胞)磨碎成粉末后,用CTAB裂解液裂解,氯仿抽提去除多聚糖等物质后,异丙醇沉淀初步纯化DNA,重新溶解DNA加入乙醇调节DNA与柱子的结合条件,过柱进一步纯化DNA,通过两步快速地洗涤柱子以去除杂质,最后用灭菌水或低盐缓冲液溶解并洗脱出DNA。标准操作步骤:
如非指出,所有离心步骤均为使用台式离心机在室温下离心。
1.液氮充分研磨样品。
2.收集研磨成粉末的50mg样品,置于1.5ml离心管中。
3.加入350μl65℃预热的缓冲液IL,并加入20μl蛋白酶K剧烈地漩涡振荡,确保所有的组织团都分散均匀。
4.65℃水浴20-30min。水浴期间颠倒样品数次。
5.加入350μl氯仿,充分混匀,12,000 rpm(~13,400×g)离心5分钟。
6.小心地把上清液吸至另一新的1.5ml离心管中。注意确保不要打散沉淀团或把组织碎片也一起转移。
7.加入4μl RNase A,涡旋混匀。室温放置2min。
8.加入二分之一上清体积的缓冲液IB与等体积的无水乙醇,充分混匀。如:向300μl上清中加入150μl缓冲液IB与300μl无水乙醇。
9.把上述混匀的液体转移到吸附柱上。10,000×g离心1 min以结合DNA,弃去滤出液体。纯化柱容量为750μl,如果混合液大于750μl,请分两次过柱。
10.将吸附柱重新套回收集管中,加入500μl缓冲液WB至柱子中,10,000×g离心1min,倒弃流出液;
11.将吸附柱重新套回收集管中,加入600μl DNA Wash Buffer至柱子中,10,000×g离心1min,倒弃流出液;
注意:DNA Wash Buffer使用前须按要求用无水乙醇稀释。如果放入冰箱中,使用前须恢复到室温。
12.再加入600μl DNA Wash Buffer至柱子中,8,000×g离心1min,弃去流出液;
13.将吸附柱重新套回2ml收集管中,转速(>13000×g)离心空结合柱1min以干燥柱子的基质;这一步对下面的洗脱步骤至关重要。
14.将柱子置于1.5ml灭菌离心管,加入50-150μl65℃预热的洗脱缓冲液EB至柱子的膜中央。室温静置5min;
15. 室温下,离心(>13000)1min,以洗脱DNA。保留含DNA的流出液。将DNA储于-20℃。
DNA浓度及纯度检测:
基因组DNA片段的大小与样品保存时间、操作过程中的剪切力等因素有关。提取的DNA片段可用琼脂糖凝胶电泳和紫外分光光度计检测浓度与纯度。可配制0.8-1.0%琼脂糖凝胶,使用λ/HindIII判断基因组的大小,完整的基因组大小应在23kb以上。使用分光光度计检测时,OD260/OD280比值应为1.7–1.9之间,如果洗脱时不使用洗脱缓冲液,而使用去离子水洗脱,比值可能偏低,但并不表明DNA纯度不高。
应用[7][8]
昆虫基因组DNA提取试剂盒可用于昆虫基因组DNA提取:
对该物种基因组微卫星特征和变异进行了较深入地分析,并优化了鳞翅目成虫DNA提取的技术方法。将传统的蛋白酶K+SDS+苯酚抽提方法和CTAB方法结合起来,筛选出从东方粘虫成虫自然种群的乙醇保存标本中提取高质量、高产量基因组DNA的方法,用于制备分离微卫星标记所需的DNA样品。
对比研究结果表明,用CTAB+传统方法提取DNA时,取腹部中段10-20 mg组织样品进行实验,不同种群DNA产品合格率68.42%-95.28%,提取合格DNA量5.59-10.04 mg/g,显著高于传统蛋白酶K+SDS裂解及苯酚抽提方法的7.69%-40%和2.83-5.78 mg/g。另外,用热NaOH法快速制备用于大规模基因分型的DNA样品的研究结果表明,对于胸部和腹部组织样品,用热NaOH溶液处理20 min,就能够提取出微卫星PCR扩增反应所需的DNA样品;对于头部组织样品,用热NaOH溶液处理40-60 min是比较合适的。
参考文献
[1]genepop’007:a complete re‐implementation of the genepop software for Windows and Linux[J].Molecular Ecology Resources.2008(1)
[2]Revising how the computer program cervus accommodates genotyping error increases success in paternity assignment[J].STEVEN T.KALINOWSKI,MARK L.TAPER,TRISTAN C.MARSHALL.Molecular Ecology.2007(5)
[3]The evolutionary origin of insect telomeric repeats,(TTAGG)N[J].Chromosome Research.2005(2)
[4]Collembola as alternative prey sustaining spiders in arable ecosystems:prey detection within predators using molecular markers[J].N.Agustí,S.P.Shayler,J.D.Harwood,I.P.Vaughan,K.D.Sunderland,W.O.C.Symondson.Molecular Ecology.2003(12)
[5]Precision studies using the ABI Prism 3100 Genetic Analyzer for forensic DNA analysis[J].Joanne B.Sgueglia,Stephana Geiger,Jeffrey Davis.Analytical and Bioanalytical Chemistry.2003(8)
[6]Genetic architecture of sexual and asexual populations of the aphid Rhopalosiphum padi based on allozyme and microsatellite markers[J].F.Delmotte,N.Leterme,J.‐P.Gauthier,C.Rispe,J.‐C.Simon.Molecular Ecology.2002(4)
[7]Strategies for microsatellite isolation:a review[J].LZane,LBargelloni,TPatarnello.Molecular Ecology.2002(1)
[8]张国彦.东方粘虫微卫星富集文库的构建与遗传标记筛选[D].南京农业大学,2009.
