概述[1]
通用型DNA纯化回收试剂盒采用独特的缓冲体系和离心吸附柱,既可从TAE或TBE琼脂糖凝胶中回收DNA片段,又可用于直接纯化PCR产物,能够满足多种实验需要。溶胶液PC中含有pH指示剂,可根据颜色来判断溶胶状态。使用本产品可回收100 bp-8 kb大小的DNA片段,回收率可达80%。使用本试剂盒回收的DNA可直接用于连接、转化、酶切、测序等分子生物学实验。

产品特点
1.兼容性强:既可用作DNA产物直接纯化,又可用作DNA凝胶回收。
2.操作简便、可回收胶体积大:可按照胶块与溶胶液等比进行溶胶。
3.稳定、可靠:配有指示剂,可直观判断影响DNA吸附的pH值,又可保证DNA与膜充分结合,提高回收效率。
试剂盒组成[1]
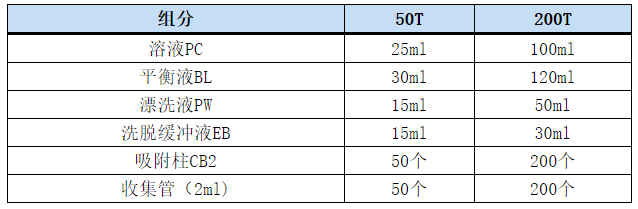
保存条件:室温(15-25℃)干燥条件下,可保存12个月,更长时间的保存可置于2-8℃。2-8℃保存条件下,若溶液产生沉淀,使用前应将试剂盒内的溶液在室温放置一段时间,必要时可在37℃水浴中预热10min,以溶解沉淀。
注意事项[1]
1.平衡液BL的加入能够改善吸附柱的吸附能力并提高吸附柱的均一性和稳定性,消除高温/潮湿或其他不良环境因素对吸附柱造成的影响。使用前请先检查平衡液BL是否出现浑浊,如有混浊现象,可在37℃水浴中加热几分钟,即可恢复澄清。
2.溶液PC含有pH指示剂,为黄色,指示pH≤7.5。
操作步骤[1]
使用前请先在漂洗液PW中加入无水乙醇,加入体积请参照瓶上的标签。
一、从琼脂糖凝胶中回收DNA片段
1.柱平衡步骤:向吸附柱CB2中(吸附柱放入收集管中)加入500μl平衡液BL,12000rpm(~13400×g )离心1 min,倒掉收集管中的废液,将吸附柱重新放回收集管中。(请使用当天处理过的柱子)
2.将单一的目的DNA条带从琼脂糖凝胶中切下(尽量切除多余部分)放入干净的离心管中,称取重量。
3.向胶块中加入等倍体积溶液PC(如果凝胶重为0.1g,其体积可视为100 μl,则加入100 μl PC溶液),50℃水浴放置10min左右,其间不断温和地上下翻转离心管,以确保胶块充分溶解。(若胶块的体积过大,可事先将胶块切成碎块)。
注意:对于回收<150 bp的小片段可将溶液PC的体积增加到3倍以提高回收率;胶块完全溶解后将溶液温度降至室温再上柱,因为吸附柱在室温时结合DNA的能力较强。凝胶完全融解后应呈现黄色,即可进行后续操作。如果胶完全融解后溶液的颜色为桔红色或紫色,请使用10 μl 3M乙酸钠(pH 5.0)将溶液的颜色调为黄色后再进行后续操作。(溶液PC中含有pH指示剂,当pH≤7.5时溶液的颜色为黄色,此时DNA才能够有效的与膜结合,当pH值偏高时溶液的颜色变为桔红色和紫色,需要进行调整。)
4.将上一步所得溶液加入一个吸附柱CB2中(吸附柱放入收集管中),12000rpm(~13400×g )离心1 min,倒掉收集管中的废液,将吸附柱CB2放入收集管中。
5.向吸附柱CB2中加入600 μl漂洗液PW(使用前请先检查是否已加入无水乙醇),12000rpm(~13400×g )离心1 min,倒掉收集管中的废液,将吸附柱CB2放入收集管中。
注意:如果回收的DNA是用于盐敏感的实验,例如平末端连接实验或直接测序,建议PW加入后静置2-5 min再离心。
6.重复操作步骤5
7.将吸附柱CB2放入收集管中,12000rpm (~13400×g )离心2 min,尽量除去漂洗液。将吸附柱置于室温放置数分钟,彻底晾干。
注意:漂洗液中乙醇的残留会影响后续的酶反应(酶切、PCR等)实验。
8.将吸附柱CB2放入一个干净离心管中,向吸附膜中间位置悬空滴加适量的洗脱缓冲液EB,(如果回收的目的片段>4 kb,则洗脱缓冲液EB应置于65-70℃水浴预热),室温放置2 min。12000rpm (~13400×g )离心2 min,收集DNA溶液。
注意:洗脱液的体积不应少于30 μl,体积过少会影响回收的效率。洗脱液的pH值对于洗脱效率有较大影响。若后续做测序,需使用ddH2O做洗脱液,并保证其pH值在7.0-8.5范围内,pH值低于7.0会降低洗脱效率;且DNA产物应保存在-20℃,以防DNA降解。为了提高DNA的回收量,可将离心得到的溶液重新加回离心吸附柱中,室温放置2 min,12000rpm(~13400×g)离心2 min,将DNA溶液收集到离心管中。
二、从PCR反应液或酶切反应液中回收DNA
1.柱平衡步骤:向吸附柱CB2中(吸附柱放入收集管中)加入500μl的平衡液BL,12000rpm(~13400×g )离心1 min,倒掉收集管中的废液,将吸附柱重新放回收集管中。(请使用当天处理过的柱子)
2.估计PCR反应液或酶切反应液的体积,向其中加入等倍体积溶液PC,充分混匀(无需去除石蜡油或矿物油)。
注意:对于回收<150 bp的小片段可将溶液PC的体积增加到3倍以提高回收率;溶液混匀后应呈现黄色,即可进行后续操作。如果溶液的颜色为桔红色或紫色,请使用10 μl 3M乙酸钠(pH 5.0)将溶液的颜色调为黄色后再进行后续操作。
3.将上一步所得溶液加入一个吸附柱CB2中(吸附柱放入收集管中),室温放2 min,12000rpm (~13400×g )离心1 min,倒掉收集管中的废液,将吸附柱放入收集管中。
注意:吸附柱容积为800 μl,若样品体积大于800 μl可分批加入。
4.向吸附柱CB2中加入600 μl漂洗液PW (使用前请先检查是否已加入无水乙醇),12000rpm(~13400×g )离心1 min,倒掉收集管中的废液,将吸附柱CB2放入收集管中。
注意:如果纯化的DNA是用于盐敏感的实验,例如平末端连接实验或直接测序,建议PW加入后静置2-5 min再离心。
5.重复操作步骤4.
6.将吸附柱CB2放回收集管中,12000rpm (~13400×g )离心2 min,尽量除去漂洗液。将吸附柱CB2置于室温放置数分钟,彻底地晾干。
注意:漂洗液中乙醇的残留会影响后续的酶反应(酶切、PCR等)实验。
7.将吸附柱CB2放入一个干净的离心管中,向吸附膜中间位置悬空滴加适量的洗脱缓冲液EB,(如果回收的目的片段>4 kb,则洗脱缓冲液EB应置于65-70℃水浴预热),室温放置2 min。12000rpm (~13400×g )离心2 min收集DNA溶液。
注意:洗脱液的体积不应少于30 μl,体积过少会影响回收的效率。洗脱液的pH值对于洗脱效率有较大影响。若后续做测序,需使用ddH2O做洗脱液,并保证其pH值在7.0-8.5范围内,且DNA产物应保存在-20℃,以防DNA降解。为了提高DNA的回收量,可将离心得到的溶液重新加回离心吸附柱中,室温放置2 min,12000rpm(~13400×g)离心2 min,将DNA溶液收集到离心管中。
主要参考资料
[1] 通用型DNA纯化回收试剂盒产品说明书
