背景[1-7]
GZD824 Dimesylate(Bcr-Abl抑制剂)是新型口服有效的Bcr-Abl抑制剂,作用于Bcr-Abl(WT)和Bcr-Abl(T315I),IC50分别为0.34 nM和0.68 nM。GZD824有效抑制了表达有野生型BCR-ABL Ba/F3细胞的生长,IC50为1.0 nM。与生化激酶抑制和蛋白质结合亲和力实验结果高度相符,GZD824也强烈抑制表达的Bcr-AblT315I突变体的Ba/F3细胞和14种抗性相关的BCR-ABL突变株的增殖。
此外,在K562白血病细胞中,GZD824有效地以浓度依赖性的方式抑制BCR-ABL以及下游CRKL和STAT5的激活。在K562肿瘤异种移植物和KU812异种移植模型中,GZD824(5和10毫克/公斤/天)剂量依赖性地抑制了肿瘤的生长,并且没有死亡或损失体重。此外,在表达的Bcr-AblWT和BCR-AblT315I的Ba/F3细胞的同种异体移植小鼠中,GZD824(20毫克/千克/天)抑制肿瘤生长。
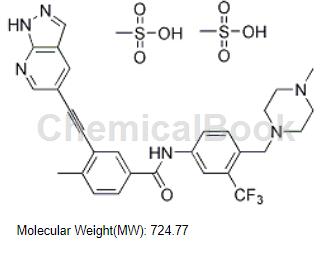
芳基炔类和三氮唑苯甲酰胺两类化合物在多种激酶、细胞和动物模型中可有效克服Bcr-AblT315I突变诱发的耐药问题。其中,化合物GZD824可以抑制Bcr-Abl WT及Bcr-Abl T315I等耐药突变体的激酶活性,并对P-loop区突变(E255K/V)等有效,在多种细胞和动物模型中表现出优异的抗肿瘤活性:针对K562、Ku812等CML肿瘤细胞的IC50为0.2~10nm;针对携带Bcr-AblT315I突变体的Ba/F3细胞的IC50约为7nm;在1.0~20.0毫克/千克/天的口服剂量下完全抑制肿瘤生长;且具有较好的安全性指标及优异的药代动力学性质:大鼠口服生物利用度约为48.7%;体内半衰期T1/2约为8~10小时。
野生型细胞中的c-Abl基因涉及DNA结合,其影响诸如DNA转录,修复,细胞凋亡和细胞周期潜在的其他过程的过程。虽然这种相互作用的性质一直存在争议,但有证据表明c-Abl磷酸化HIPK2,一种丝氨酸/苏氨酸激酶,响应DNA损伤并促进正常细胞的凋亡。相反,BCR-ABL融合体已被证明可抑制细胞凋亡,但其对DNA结合的影响尚不清楚。
在细胞凋亡抑制中,已经显示BCR-ABL细胞对药物诱导的细胞凋亡具有抗性,但是通过增加p53,p21和Bax的表达水平也具有促凋亡表达谱。然而,这些促凋亡蛋白的功能受损,并且在这些细胞中不进行细胞凋亡。BCR-ABL还涉及预防胱天蛋白酶9和半胱天冬酶3加工,这增加了抑制作用。阻止细胞周期进展和凋亡的另一个因素是IKAROS基因的缺失,其中>80%的Ph染色体阳性ALL病例。
IKAROS基因对于Ph中阳性的ALL细胞中Pre-B细胞受体介导的细胞周期停滞至关重要,当受损时,BCR-ABL酪氨酸激酶信号传导促进了受损细胞周期进展和缺陷细胞增殖的机制。BCR-ABL融合基因该基因编码的P210蛋白质增强了酪氨酸激酶的活性,从而产生了细胞凋亡的抑制作用,这与慢性粒细胞白血病的发生有着密切关联。个小分子靶向抗肿瘤药物是伊马替尼(imatinib),它可以有效抑制BCR-ABL激酶。然而随着不同种类的突变型BCR-ABL激酶的出现,伊马替尼却无可奈何。
第二代BCR-ABL激酶抑制剂主要针对伊马替尼耐药的突变型BCR-ABL,并同时出现了作用于多靶点的治疗慢性粒细胞白血病的抑制剂,但这些都无法对T315I突变型BCR-ABL激酶起效。第三代BCR-ABL激酶抑制剂主要针对T315I突变型BCR-ABL激酶,包括单独抑制以及与其他药物协同作用,同时也正在尝试提高药物的选择性,减少不良反应的发生。BCR-ABL激酶抑制剂经历了由单靶点到多靶点的发展历程,在攻克野生型及突变型BCR-ABL激酶各个治疗难题的同时,正向着高选择性高有效性的方向不断发展。
应用[8][9]
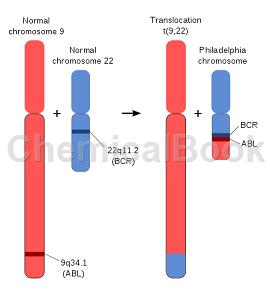
GZD824 Dimesylate(Bcr-Abl抑制剂)可用于Bcr–Abl癌蛋白慢性粒细胞白血病的研究:
BCR-ABL是一种由bcr基因和c-abl原癌基因融合产生的致癌基因。该基因表达的Bcr–Abl癌蛋白是慢性粒细胞白血病的病理学基础。因此研发选择性的Bcr–Abl酪氨酸激酶抑制剂成为治疗慢性粒细胞白血病的一种有效策略。9号染色体的BCR基因与22号染色体的c-ABL基因形成了新的基因序列——BCR-ABL融合基因。该基因编码的P210蛋白质增强了酪氨酸激酶的活性,从而产生了细胞凋亡的抑制作用,这与慢性粒细胞白血病的发生有着密切关联。慢性粒细胞白血病(chronic myelogenous leukemia,CML)是自我更新的造血干细胞恶性骨髓增生性疾病,约90%的患者外周血细胞中可以检测到一种异常染色体——PH染色体。
参考文献
[1]ABL kinase inhibitory and antiproliferative activity of novel picolinamide based benzothiazoles[J].Ashraf Kareem El-Damasy,Nam-Chul Cho,Soon Bang Kang,Ae Nim Pae,Gyochang Keum.Bioorganic&Medicinal Chemistry Letters.2015(10)
[2]Expanding the structural diversity of Bcr-Abl inhibitors:Hybrid molecules based on GNF-2 and Imatinib[J].Xiaoyan Pan,Jinyun Dong,Ruili Shao,Ping Su,Yaling Shi,Jinfeng Wang,Langchong He.Bioorganic&Medicinal Chemistry Letters.2015(19)
[3]Design,synthesis and biological evaluation of deuterated Tivozanib for improving pharmacokinetic properties[J].Shiwei Guo,Xuehai Pang,Lingling Peng,Miao Zhan,Lei Fan,Yu Gong,Fanyuan Kang,Yuanwei Chen.Bioorganic&Medicinal Chemistry Letters.2015(11)
[4]The background,discovery and clinical development of BCR-ABL inhibitors[J].Gemma K.Lambert,Anne-Kathrin Duhme-Klair,Trevor Morgan,Manoj K.Ramjee.Drug Discovery Today.2013(19-2)
[5]Mechanisms of resistance to BCR-ABL and other kinase inhibitors[J].Allan Joaquim Lamontanara,Emel Basak Gencer,Orest Kuzyk,Oliver Hantschel.BBA-Proteins and Proteomics.2013(7)
[6]Design,synthesis and biological evaluation of novel acrylamide analogues as inhibitors of BCR–ABL kinase[J].Shuxin Li,Zhenglin Yao,Yanjin Zhao,Wei Chen,Huijia Wang,Xianzhao Kuang,Wenhu Zhan,Shan Yao,Shanyou Yu,Wenxiang Hu.Bioorganic&Medicinal Chemistry Letters.2012(16)
[7]Structural approaches to obtain kinase selectivity[J].Richard A.Norman,Dorin Toader,Andrew D.Ferguson.Trends in Pharmacological Sciences.2012(5)
[8]BCR-ABL tyrosine kinase inhibitors in the treatment of Philadelphia chromosome positive chronic myeloid leukemia:A review[J].Xin An,Amit K.Tiwari,Yibo Sun,Pei-Rong Ding,Charles R.Ashby,Zhe-Sheng Chen.Leukemia Research.2010(10)
[9]李琳毅,徐云根.BCR-ABL激酶抑制剂的研究进展[J].中国现代应用药学,2016,33(07):954-962.
