背景[1-7]
小鼠脂肪酸代谢PCR芯片运用高通量荧光定量PCR方法,在一张96孔或384孔板上同时对某个信号通路或疾病相关基因的表达量变化进行检测,芯片上的基因包括了与研究对象有确定关系的基因或者待考证的基因;目前启因生物针对不同的信号通路和疾病相关基因设计了150多款功能分类PCR芯片,涵盖生命科学研究的各个领域。
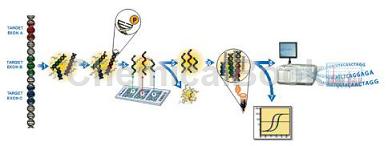
小鼠脂肪酸代谢PCR芯片含有84个小鼠脂肪酸代谢基因,包括脂肪酸分解代谢,脂肪酸运输,脂肪酸生物合成的调节,生酮作用等。脂肪代谢是体内重要且复杂的生化反应,指生物体内脂肪,在各种相关酶的帮助下,消化吸收、合成与分解的过程,加工成机体所需要的物质,保证正常生理机能的运作,对于生命活动具有重要意义。脂类是身体储能和供能的重要物质,也是生物膜的重要结构成分。脂肪代谢异常引发的疾病为现代社会常见病。
脂肪的消化主要在小肠上段经各种酶及胆汁酸盐的作用,水解为甘油、脂肪酸等。脂类的吸收有两种:中链、短链脂肪酸构成的甘油三酯乳化后即可吸收,经由门静脉入血;长链脂肪酸构成的甘油三酯与载脂蛋白、胆固醇等结合成乳糜微粒,最后经由淋巴入血。脂肪吸收后在体内代谢的生化过程主要分成:甘油三酯、磷脂、胆固醇、血浆脂蛋白四类脂类物质的代谢,受胰岛素、胰高血糖素、饮食营养、体内生化酶活性等复杂而精密的调控,转变成身体各种精细生化反应所需要的物质成分。
肝、脂肪组织、小肠是合成脂肪的重要场所,以肝的合成能力最强。合成后要与载脂蛋白、胆固醇等结合成极低密度脂蛋白(VLDL),入血运到肝外组织储存或加以利用。若肝合成的甘油三酯不能及时转运,会形成脂肪肝。长期饥饿,糖供应不足时,脂肪酸被大量动用,生成乙酰CoA氧化供能,并产生大量酮体。肝是生成酮体的器官,但不能利用酮体。脑组织不能利用脂肪酸,而酮体溶于水,分子小,可通过血脑屏障。严重糖尿病患者,葡萄糖得不到有效利用,脂肪酸转化生成大量酮体,超过肝外组织利用的能力,引起血中酮体升高,可致酮症酸中毒。
应用[8][9]
小鼠脂肪酸代谢PCR芯片可用于小鼠模型脂肪酸代谢通路研究:
以APP/PS1双转基因AD模型小鼠及野生小鼠为实验对象,对比分析两组小鼠大脑脂肪酸组成及含量、肝脏脂肪酸β-氧化相关酶及因子表达水平有无差异,为探明AD发生与脂肪酸含量及代谢功能的关系提供实验依据。
方法部分:APP/PS1双转基因AD模型小鼠大脑皮质脂肪酸变化选取6月龄APP/PS1双转基因AD模型小鼠(转基因组)和同源野生小鼠(野生组)各10只,采用Morris水迷宫实验测定小鼠空间学习记忆能力,气相色谱法分析大脑皮质脂肪酸组成及含量,用生化试剂盒测定血清总胆固醇(TC)、三酰甘油(TG)、游离脂肪酸(FFA)含量。第二部分:APP/PS1双转基因AD模型小鼠肝脏脂肪酸β-氧化相关酶及因子表达水平变化取部分转基因组和野生组小鼠的肝脏用于本部分实验。
用qRT-PCR方法测定肝脏组织中线粒体β-氧化关键酶肉碱脂酰转移酶Ⅰ(CPT1)、过氧化物酶体β-氧化关键酶脂酰辅酶A氧化酶1(ACOX1)、D-双功能蛋白(DBP)、L-双功能蛋白(LBP)和调控脂肪酸代谢的过氧化物酶体增殖剂激活受体α(PPARα)的mRNA表达水平,用Western Blot方法测定肝脏组织脂肪酸β-氧化相关酶及因子CPT1、ACOX1、PPARα的蛋白表达水平。
阿尔茨海默病(Alzheimer’s disease,AD)是老年痴呆最常见的形式,其病因不明是目前临床不能有效预防和治疗的重要原因。近年来大量研究表明,脂肪酸与AD发生有关,饮食中脂肪酸的种类及含量影响AD的发病风险,同时AD患者脑内及血清脂肪酸含量也与正常同龄人不同。体内脂肪酸主要经线粒体和过氧化物酶体β-氧化途径分解,研究表明脂肪酸β-氧化功能异常导致体内脂肪酸含量变化。
参考文献
[1]Application of metabolomics based on direct mass spectrometry analysis for the elucidation of altered metabolic pathways in serum from the APP/PS1 transgenic model of Alzheimer’s disease[J].Raúl González-Domínguez,Tamara García-Barrera,Javier Vitorica,JoséLuis Gómez-Ariza.Journal of Pharmaceutical and Biomedical Analysis.2015
[2]Metabolomic screening of regional brain alterations in the app/ps1 transgenic model of alzheimer’s disease by direct infusion mass spectrometry[J].Raúl González-Domínguez,Tamara García-Barrera,Javier Vitorica,JoséLuis Gómez-Ariza.Journal of Pharmaceutical and Biomedical Analysis.2014
[3]Metabolic functions of peroxisomes in health and disease[J].Ronald J.A.Wanders.Biochimie.2014
[4]Diet,cognition,and Alzheimer’s disease:food for thought[J].Ane Otaegui-Arrazola,Pilar Amiano,Ana Elbusto,Elena Urdaneta,Pablo Martínez-Lage.European Journal of Nutrition.2014(1)
[5]The Role of Nutrition and Diet in Alzheimer Disease:A Systematic Review[J].Rusha Shah.Journal of the American Medical Directors Association.2013(6)
[6]Peroxisomes,cell senescence,and rates of aging[J].Courtney R.Giordano,Stanley R.Terlecky.BBA-Molecular Basis of Disease.2012(9)
[7]Induction of Mitochondrial Changes Associated with Oxidative Stress on Very Long Chain Fatty Acids(C22:0,C24:0,or C26:0)-Treated Human Neuronal Cells(SK-NB-E)[J].Amira Zarrouk,Anne Vejux,Thomas Nury,Hammam I.El Hajj,Madouda Haddad,Mustapha Cherkaoui-Malki,Jean-Marc Riedinger,Mohamed Hammami,Gérard Lizard,Christopher Horst Lillig.Oxidative Medicine and Cellular Longevity.2012
[8]Evidence of oxidative stress in very long chain fatty acid–Treated oligodendrocytes and potentialization of ROS production using RNA interference-directed knockdown of ABCD1 and ACOX1 peroxisomal proteins[J].M.Baarine,P.Andréoletti,A.Athias,T.Nury,A.Zarrouk,K.Ragot,A.Vejux,J.-M.Riedinger,Z.Kattan,G.Bessede,D.Trompier,S.Savary,M.Cherkaoui-Malki,G.Lizard.Neuroscience.2012
[9]]孟冬丽.APP/PS1双转基因AD模型小鼠脂肪酸含量及代谢的变化[D].新乡医学院,2016.
